糖鎖科学と糖鎖医療の革新的な技術から生まれた糖鎖バイオマーカー/体外診断薬(IVD)は、人々の健康に貢献します。
♦ 糖鎖バイオマーカー/体外診断用医薬品
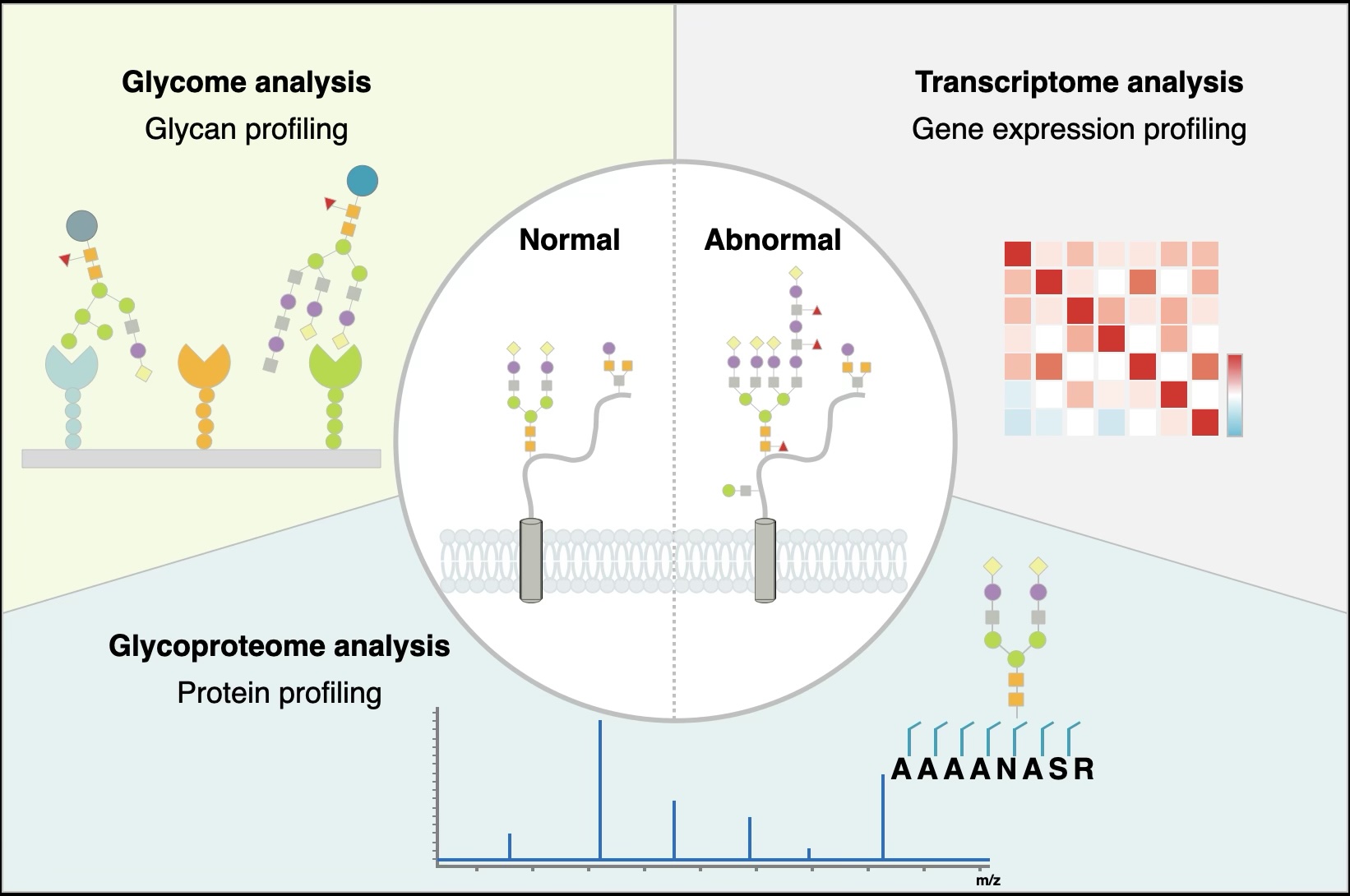
糖鎖構造を標的としたバイオマーカー/体外診断用医薬品
「糖鎖」は、生物における第4の生命鎖であり、細胞・臓器や個人の違いを提示する分子です。さらに同じタンパク質であっても、感染症や癌など病気の状態に応じて糖鎖修飾が変化することが明らかとなり、“質的な変化”を検出できる疾患特異的な糖鎖バイオマーカーは、個別化医療(プレシジョン・メディスン)の観点からも非常に重要とされています。
とりわけ、がんを含む慢性進行性疾患においては、疾患に関わるタンパク質の責任病巣における量的変化があっても、それが有意に検出できる量として血中で増加しないため、優れた診断用バイオマーカーになることは極めて難しいとされています。
一方で、病気の進行や回復の程度に応じて、同じタンパク質であってもそれを修飾する糖鎖構造は異なることから「糖タンパク質=グライコバイオマーカー」として検出することが、個別化医療時代のマーカーとして極めて重要です。
また、糖鎖修飾パターンには個人差があることから、同じ薬剤に対する治療効果も異なることが知られており、薬剤の治療効果判定や治療抵抗性の判断に貢献することも可能です。
当社では、糖タンパク質の糖鎖構造解析、目的糖タンパク質に結合する抗体の作製などの技術を有しており、新規バイオマーカーや体外診断用医薬品の開発を行っています。
B型肝炎ウイルス 糖鎖バイオマーカーHBsAgGi
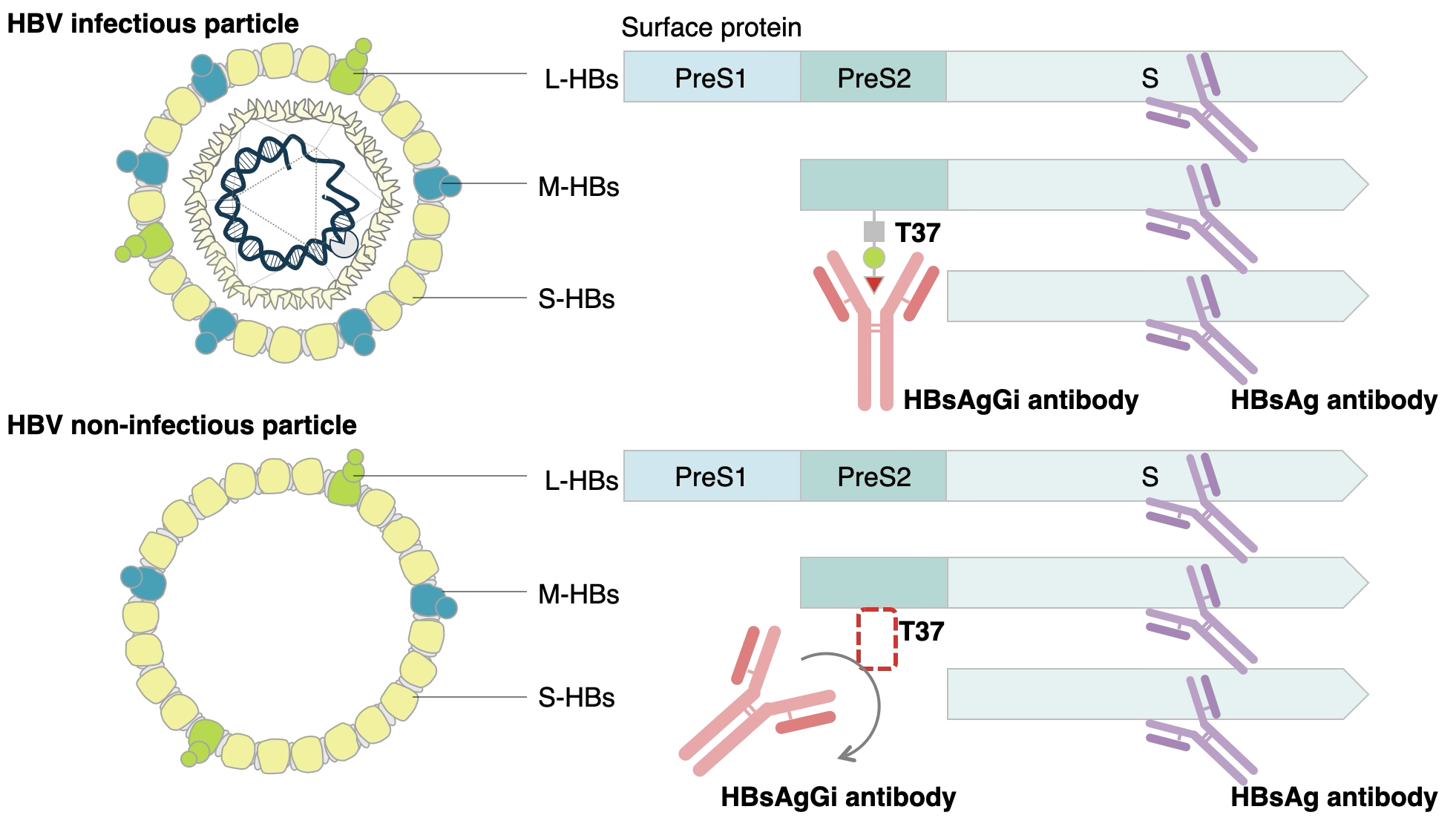
B型肝炎は、B型肝炎ウイルス(HBV)に感染することによって生じ、B型肝炎が持続すると慢性肝炎から肝硬変、さらには肝がん(肝細胞癌)へと進展する可能性があることから世界的にも重要な医療課題とされています。1
HBV粒子は、 PreS1、PreS2、Sドメインを含む、3種類の表面抗原タンパク質、S-、M-、L-HBsAgから構成されており、N型糖鎖やO型糖鎖による修飾がされ、その糖鎖構造によって、ウイルスの分泌や安定性に関与することが明らかとなっています。2,3,4
一方、臨床においては慢性B型肝炎患者の血中に含まれる感染性粒子(RNAビリオンおよびDNAビリオン)が、非感染性粒子(EmptyビリオンおよびSubviral particles=SVP)の1/100~1/10000程度しか存在していないことが知られており、感染性粒子のみを特異的に検出するバイオマーカーが望まれています。
当社では、糖鎖関連技術を活用し、日本や中国などの東アジアで多く見られるgenotype CのHBVにおいて、 M-HBsAgのPreS2ドメインが「感染性粒子」特異的にO型糖鎖修飾されていることを明らかとしました。5,6
当社で開発したモノクローナル抗体(HBsAgGi)は、感染性粒子に特異的なO型糖鎖修飾されたM-HBsAg を認識します。既存のバイオマーカーであるHBsAgが感染性粒子だけでなく非感染性粒子も認識するのに比べ、感染性粒子のみを特異的に検出するため、慢性B型肝炎の病勢のモニタリングに用いることが可能なバイオマーカーです。
特に、現在の慢性B型肝炎治療の主流である核酸アナログ製剤により、 HBV-DNAが減少した患者において増加するとされるHBV-RNAを含む感染性粒子も検出することができる特徴を有しており、DNA抑制化後の病勢モニタリングにも非常に有用です。7
当社では、体外診断用医薬品として承認を取得したほか、同様の抗体を用いた研究用試薬の販売や、受託測定サービスも行っています。
参考文献:
1. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
2. Schadler and Hildt (2009) Viruses 1:185-209. doi: 10.3390/v1020185.
3. Schmitt et al. (2004) J Gen Virol 85:2045-2053. doi: 10.1099/vir.0.79932-0.
4. Dobrica et al. (2020) Cells 9:1404. doi: 10.3390/cells9061404.
5. Wagatsuma et al. (2018) Anal Chem 90:10196-10203. doi: 10.1021/acs.analchem.8b01030
6. Angata et al. (2021) Biochim Biophys Acta Gen Subj. In Press. doi:10.1016/j.bbagen.2021.130020
7. Wang et al. (2016) J Hepatol. 65:700-710. doi: 10.1016/j.jhep.2016.05.029.
糖鎖構造を標的とした抗体医薬品
♦ 糖鎖標的治療用抗体受託サービス
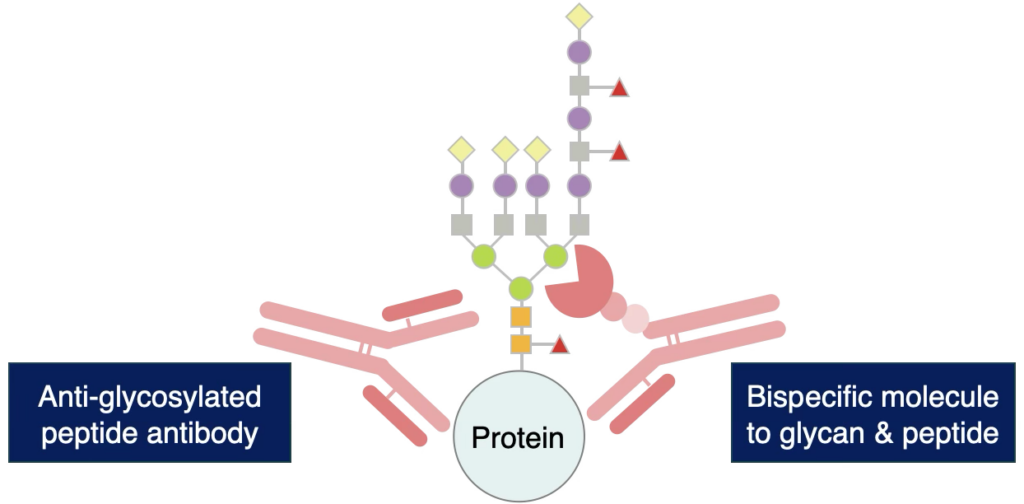
糖鎖構造は優れたバイオマーカーになるだけでなく、疾患の治療標的そのものとなります。
特にN型糖鎖修飾(N-グリコシル化)は、その高度に分岐した構造に由来して、既存の抗体医薬品の結合を妨げて、その薬理作用を減弱させたり、体内の免疫システムから逃れる“Immune evasion”の原因として知られています。
通常、 N-グリコシル化された治療標的分子に対する抗体は取得することが難しいとされています。当社は、これまでに行ってきた糖鎖研究のノウハウを生かして、高度に分岐したN-グリコシル化治療標的に対する特異性の高い抗体/抗体レクチンキメラの開発を可能とする、独自のプラットフォーム “Glea™ platform”を確立しました。
当社では、 “Glea™ platform”を活用して、お客様が関心を持つN-グリコシル化標的に対する抗体を作製するサービスを提供しています。
研究開発担当:山田 洋介(研究開発部長)
2012年 千葉大学 医学薬学府博士課程修了(薬学博士)
2012年~ 大正製薬株式会社入社(創薬化学研究室、創薬技術研究室)
2017年 米国Vanderbilt大学留学
2021年~ 株式会社キュライオ入社(創薬化学研究室長)
2022年 東京都立大学 経営学修士課程修了(経営学修士)
2024年~ 現職
- これまでに国内製薬企業にて約10年および国内バイオベンチャーにて約3年の医薬品研究開発の経験を有し、感染症領域を含む複数の創薬プロジェクトをリード。
- 創薬ステージとしては初期の探索段階から開発化合物同定、およびその後の前臨床試験段階の経験を有し、物質特許および製法特許等の取得実績がある。
- 英国および仏国の企業との共同研究も主導し成功に導くなど、創薬領域での実績を有する。
主要論文・特許:
・Bioorganic & Medicinal Chemistry Letters, 29, (2019), 2670-2674
・Journal of Medicinal Chemistry, 63, (2020), 14805-14820
・Bioorganic & Medicinal Chemistry Letters, 50, (2021), 128342
・Antiviral Research, 234, (2025), 106077
・WO2014/199960
・JP2016/199499
・WO2018/216822
・WO2018/216823